Nuevos estrógenos: esquemas, ventajas y desventajas
 AUTORES:
AUTORES:
Dra. Carlota López Kaufman
Jefa Sección Adolescencia – Dpto. Materno Infantil
Hospital Gral. de Agudos Bernardino Rivadavia
Buenos Aires, Argentina
Reprint:
Sección Adolescencia Tel (54 11) 4809-2000 int. 2127
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Resumen
Evitar embarazos no planificados ha sido motivo de preocupación a lo largo de la historia de la anticoncepción. El hombre a través del tiempo ha buscado distintas técnicas y procedimientos para limitar el número de hijos, los cuales fueron influenciados por las características económicas, demográficas, sociales y religiosas que afectaron a los pueblos a través de los siglos.
Es así, que a través del tiempo se fueron ideando y estudiando una gran variedad de métodos, dentro de los cuales, los métodos hormonales han y siguen siendo los más investigados y estudiados, no solo para mejorarlos como anticonceptivos, y tener cada vez menos efectos indeseables, sino también por el descubrimiento de otras indicaciones y beneficios.
Los anticonceptivos orales combinados han pasado por varias etapas de evolución. Los avances más importantes para mejorar la eficacia, seguridad y tolerabilidad han sido las modificaciones en las dosis, incorporación de nuevos progestágenos y estrógenos naturales, y diferentes esquemas de administración.
Introducción
Desde la aparición del primer anticonceptivo oral combinado (ACO) en 1960, la píldora anticonceptiva ha sido utilizada por millones de mujeres en edad reproductiva.
Los avances en anticoncepción hormonal se debieron a que eran asociados a efectos adversos y colaterales como resultado de las dosis y características de sus componentes que llevaban a la discontinuación, con aumento de los embarazos no planificados.
En los intentos de mejorar estos resultados adversos se desarrollaron regímenes con dosis más bajas de etinilestradiol (EE), incorporación de nuevos progestágenos y estrógenos naturales, diferentes esquemas de administración, y reducción del intervalo libre de hormonas 1
Disminución de la dosis de estrógeno
La disminución de la dosis de estrógeno fue motivada dado que a partir de los años ‘60, más específicamente en 1961, comenzaron a aparecer estudios epidemiológicos que demostraban su asociación con complicaciones como ACV, tromboembolismo e infarto de miocardio, y para reducir otros eventos adversos (edema, tensión mamaria, náuseas) producto de la dosis de estrógeno. 2,3
Pero a pesar de esa reducción, con 20 µg EE se observó un incremento del sangrado irregular (amenorrea o sangrado infrecuente, deprivación prolongada, manchado o “spotting”), y que estas alteraciones ocurrían con diferentes tipos y dosis de progestágenos encontrándonos ante otro riesgo como es la discontinuación temprana del anticonceptivo. Por lo tanto, era necesaria una mayor dosis de EE para mantener un buen control del ciclo. 4
Esquemas de administración
Otras de las modificaciones que se desarrollaron a través de los años fueron diferentes esquemas de administración para reducir riesgos y efectos adversos asociados al uso de ACO. Originalmente fueron diseñados para mimetizar el ciclo menstrual de 28 días (21 días de tratamiento activo y 7 días de intervalo libre). (Fig. 1)
Los primeros esquemas fueron monofásicos, y en los ’80 aparecen los bifásicos y trifásicos para reducir las dosis de los esteroides en cada ciclo y simular las fluctuaciones fisiológicas del ciclo menstrual. 5
Pero la disminución de la dosis de estrógenos se asociaba con la aparición de síntomas durante el período libre de hormonas. Esto motivó que en los ’90 se introdujeran los primeros ACO con reducción del intervalo libre (HFI - hormonal free interval - por sus siglas en inglés) (regímenes 24/4, 26/2), con el objetivo de reducir los síntomas del HFI y permitir un sangrado más corto y más leve que con los tradicionales 21/7.
Pero… el sangrado cíclico no es esencial. Las actitudes de las mujeres y profesionales hacia el uso de regímenes continuos y extendidos fueron evaluadas para determinar cómo era percibida la supresión de la menstruación. Las encuestas revelaron el interés de la mujer en reducir la frecuencia de la menstruación 6. Algunos estudios mostraron que el 37% a 46% de las mujeres desearían no menstruar. 7
Nakajima (2007) y Edelman (2014) demostraron que el esquema extendido con 84 días de estrógeno y gestágeno asociado a 7 días de placebo, y por lo tanto 4 sangrados/año tenía una efectividad muy buena, con disminución de los síntomas asociados al HFI 8, pero hay algunos reportes que mencionan la frecuente aparición de manchado luego de 4 ciclos. 9
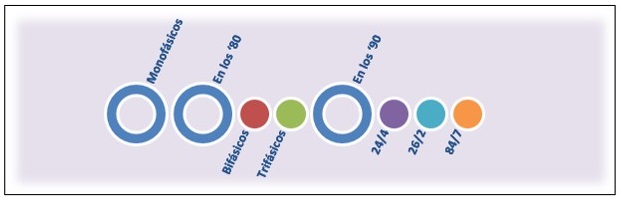
Fig. 1: Diferentes esquemas de administración
Estrógenos utilizados en anticonceptivos orales combinados (AOC΄s)
Como mencionara anteriormente, la disminución en la dosis del EE (de 50 µg a 30 µg) se asoció a una disminución de los efectos cardiovasculares, pero, también se observó, que con dosis de EE 20 µg se presentaban altas tasas de sangrado irregular llevando a una discontinuación del uso del anticonceptivo.
Desde entonces, las investigaciones se orientaron a reemplazar el EE (estrógeno sintético) con estradiol (E₂) o valerato de estradiol (VE₂) (ambos estrógenos naturales) para mejorar los perfiles de seguridad y tolerabilidad, los efectos cardiovasculares, los parámetros hemostáticos, y el metabolismo lipídico. Pero, tenían un pobre control del ciclo, especialmente cuando formaban parte de un régimen monofásico o bifásico 10,11
También, se deben tener en cuenta algunos factores que determinan la elección del método anticonceptivo en la mujer que incluyen la experiencia previa que se haya tenido con otros anticonceptivos hormonales, la facilidad para su uso, su tolerancia, la satisfacción con el método y la calidad de vida.
Hay estudios donde se menciona que el 29% de las mujeres que habían iniciado ACO lo discontinuaron por: efectos colaterales (64.6%), preocupación por los efectos adversos (13.1%) y las alteraciones en el ciclo (12%), y las que no estaban satisfechas debido a estos efectos deseaban evitar el uso de hormonas sintéticas o "hacer descansos para que su cuerpo se recuperara de las hormonas que ellas consideraban no naturales." 12-13
El estudio ZOCAL evaluó los cambios en la calidad de vida en mujeres que habían iniciado ACO con un estrógeno natural. Participaron 102 centros en España, y completaron el estudio 785 mujeres entre 18 a 49 años durante un periodo de 6 meses. Las formulaciones indicadas fueron E₂/NOMAC y VE₂/DNG. La Sociedad Española de Contracepción utilizó una escala validada para evaluar la calidad de vida en usuarias de ACO (SEC-QOL). Si bien el estudio tiene debilidades, pues hubo mayor cantidad de usuarias de E₂/NOMAC, y la duración fue solo de 6 meses, los resultados globales y secundarios (síntomas premenstruales, sangrado intermenstrual, duración e intensidad del sangrado, tasa de continuación y tolerancia) mostraron cambios favorables en aquellas usuarias que decidieron cambiar por un ACO con un estrógeno natural. 14
Por lo tanto, ante la indicación de un anticonceptivo hormonal, se debe tener en cuenta: el balance riesgo-beneficio, la elevada eficacia, adherencia y aceptabilidad para asesorar sobre el mejor método aplicable disponible.
Nuevos estrógenos. Esquemas
El primer estrógeno natural introducido fue el valerato de estradiol asociado al dienogest (VE₂/DNG) en un régimen dinámico con dosis decrecientes de VE₂ y crecientes de DNG, siguiendo ambos esteroides los patrones de un ciclo menstrual (26/2). (Fig. 2)
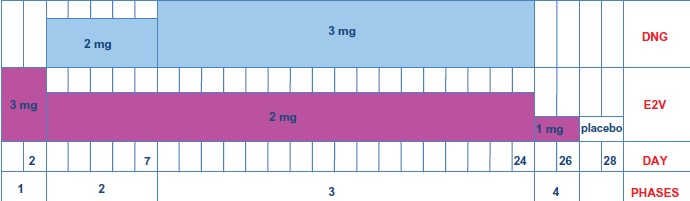
Fig. 2: Formulación VE₂/DNG: 3 mg VE₂ durante 2 días, 2 mg VE₂ + 2 mg DNG durante 5 días, 2 mg VE₂ + 3 mg DNG durante 17 días, 1 mg VE₂ durante 2 días, y 2 comprimidos inactivos durante 2 días.
Esta liberación hormonal fue diseñada para dar una dominancia estrogénica en el inicio del ciclo permitiendo la proliferación endometrial y, por lo tanto, aumentar la sensibilidad a la acción del gestágeno en la mitad del ciclo, y asegurar una estabilidad endometrial para tener un perfil de sangrado predecible.
La administración de VE₂ al final del ciclo durante 2 días hace que los niveles de estrógeno permanezcan relativamente estables a través del ciclo.
El DNG, pues, tiene alta afinidad endometrial (efecto uterotrópico) y dominancia desde la mitad del ciclo hasta la última parte, asegurando la estabilidad endometrial hacia el final del ciclo.
Otra formulación disponible es un régimen monofásico con 24 comprimidos activos y 4 inactivos (24/4) que contiene 1.5 mg 17 ß estradiol (E₂) + 2.5 mg acetato de nomegestrol (E₂/NOMAC). Las investigaciones demostraron una muy buena eficacia, con buen control del ciclo, y menor impacto en los efectos metabólicos, incluyendo los de la coagulación (Fig. 3)

Fig. 3: 24 comprimidos conteniendo 1.5 mg 17 ß estradiol (E₂) + 2.5 mg acetato de nomegestrol y 4 comprimidos inactivos
La elección del porqué de la asociación con estos gestágenos la observamos en el Cuadro 1.
Dienogest |
Nomegestrol |
|
Fuerte efecto progestacional endometrial |
Fuerte efecto progestacional y antiestrogénica sobre la proliferación endometrial
Leve acción antiandrogénica |
Cuadro 1: Diferencias entre gestágenos
Ventajas de los nuevos esquemas
• Control del ciclo (Fig. 4)
Las investigaciones realizadas desde los años ’70 no solo se orientaron a mejorar los perfiles de seguridad y tolerabilidad, sino también, a mejorar la estabilidad del ciclo.
La potencia del E₂ sobre la proliferación endometrial es similar al EE, sin embargo, debido a la actividad de la 17β-hidroxiesteroide dehidrogenasa (17β-HSD), que es estimulada por los progestágenos, transforma rápidamente al E₂ en E₁, el cual no puede mantener estable la proliferación endometrial.
Además, los gestágenos reducen las concentraciones de receptores nucleares de E₂ disminuyendo la biodisponibilidad del mismo y la proliferación endometrial. Por lo tanto, parece que la disminución de la proliferación endometrial depende del efecto antiestrogénico del gestágeno.
Las nuevas formulaciones que combinan E₂ con un progestágeno con menor potencia antiestrogénica redujeron el endometrio inestable.
El predominio inicial de VE₂ evita el impacto negativo del progestágeno, y NOMAC inhibe la producción de E₁ a partir de E₂ logrando niveles más constantes de E₂ y la larga vida media del NOMAC produciría una proliferación endometrial más estable. 15-17
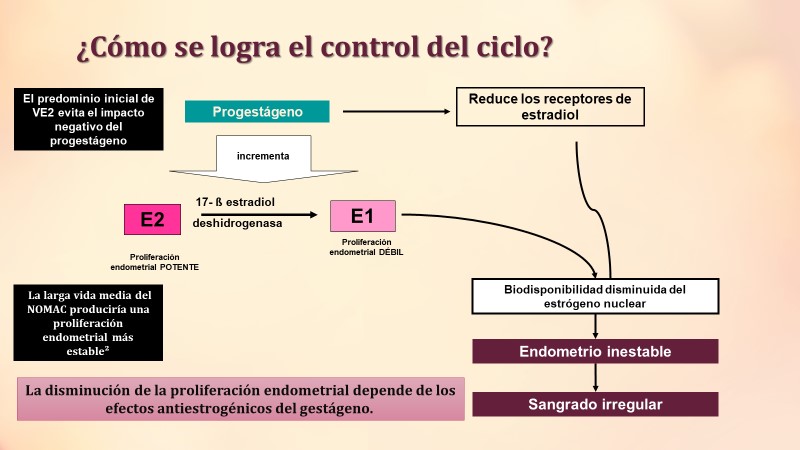
Fig. 4: Control del ciclo
• Patrón de Sangrado
En el régimen 24/4 los niveles estables de estradiol, y larga vida media del NOMAC han mostrado un sangrado más liviano, ausencia de sangrado esperado entre 3 al 25% de las usuarias, y sangrado intermenstrual entre 14 - 20%. Sólo 4% de las mujeres suspendió el tratamiento por sangrado inaceptable, en general porque no habían estado alertadas de la posibilidad de amenorrea. 18
Con el régimen 26/2 los niveles estables de estradiol, y el fuerte efecto progestacional del DNG se observo un sangrado más liviano o manchado, ausencia de sangrado esperado (19-24%), y sangrado intermenstrual (13-23%). 19
• Sangrado menstrual abundante y/o prolongado
El VE₂/DNG es un tratamiento efectivo en mujeres con sangrado menstrual abundante y/o prolongado sin patología orgánica reconocible.
La FDA lo aprobó en 2012 para el tratamiento del sangrado menstrual abundante (HMB, por sus siglas en inglés) que no es causado por ninguna condición en el útero, en las mujeres que eligen un anticonceptivo oral para el control de la natalidad.
Se realizaron dos estudios aleatorizados, doble ciego y controlados con placebo para investigar la eficacia y seguridad de VE₂/DNG en el tratamiento del sangrado menstrual abundante (SMA) confirmado.
Un estudio se realizó en los EUA y Canadá 20 y el otro en Australia y varios países de Europa 21. Los diseños y planes de análisis de ambos estudios fueron idénticos.
Fueron elegibles para participar en los estudios mujeres sanas con edades de 18 años o más que tenían sangrado menstrual abundante, prolongado o frecuente sin patología orgánica y que deseaban anticoncepción hormonal.
Cada estudio asignó aleatoriamente (2:1) a pacientes con 1 o más de los siguientes trastornos: Sangrado abundante - Sangrado prolongado - Sangrado frecuente.
Después de 6 meses de tratamiento, la mediana de pérdida sanguínea menstrual (PSM) mensual había disminuido 88% (de 142 mL a 17 mL por ciclo de tratamiento) en el grupo VE₂/DNG (n=269) en comparación con 24% (de 154 mL a 117 mL por ciclo de tratamiento) en el grupo placebo (n=152). 22
El VE₂ /DNG demostró ser un tratamiento efectivo para el SMA sin causa orgánica por reducción rápida, sustancial y sostenida del SMA, mejoría en parámetros de metabolismo del hierro, por un perfil de seguridad positivo, altamente tolerable, y mejoría en parámetros de productividad laboral y actividades de la vida diaria en mujeres con SMA.
• Síntomas que se asocian al intervalo libre de hormonas
Las usuarias de ACO han manifestado algunos síntomas asociados al intervalo libre de hormonas (HFI) (hinchazón, cefaleas, dolor pelviano, mastalgia) que pueden ser ocasionados por la disminución de las hormonas exógenas y las fluctuaciones de los estrógenos endógenos durante el HFI. Estos síntomas traen aparejados una disminución de la satisfacción y calidad de vida, una baja adherencia al ACO, y discontinuación de los mismos.
Algunos tratamientos han incluido regímenes de ACO con disminución del intervalo libre (continuos o extendidos) pero pueden causar sangrados no predecibles. La FDA ha aprobado diferentes regímenes: 24/4 – 26/2 – 84/7 y continuo por 365 días pues diferentes investigaciones han observado una mejor supresión del crecimiento folicular, reducción de los niveles de FSH, sangrados más breves, y disminución de la sintomatología por deprivación hormonal.
Estos regímenes pueden ser usados por cualquier mujer. El tipo de esquema puede ser determinado en base a las preferencias de la mujer y experiencia con diferentes regímenes. En líneas generales, las jóvenes prefieren menos ciclos por año (4/año) mientras que las adultas prefieren no menstruar. 23
Con cualquier tipo de régimen extendido, el sangrado intermenstrual o manchado puede ocurrir y es necesario explicarlo antes de iniciar la toma. Si el sangrado se torna inaceptable, una suspensión de 3 días es conveniente. 24
El estudio fase III, multicéntrico, doble ciego HARMONY I y II demostró que el
VE₂/DNG proporcionó una reducción significativa en la frecuencia e intensidad de la cefalea y dolor pelviano durante el HFI que un intervalo de 21/7 con un régimen trifásico con EE/Norgestimato o EE/LNG en mujeres entre 18 a 50 años, durante 6 ciclos de tratamiento.
Los principales resultados muestran que el VE₂/DNG produce una reducción del dolor pelviano y la cefalea durante el periodo que va del día 22 al día 28 del ciclo comparado con EE/LNG (HARMONY II).
Cerca del 50% de las usuarias tuvieron una reducción de 75% del dolor pélvico y de cabeza, en comparación al período previo al inicio del tratamiento, sin necesidad de toma de ningún analgésico. En cambio, solamente 30% de las usuarias de EE/LNG mostraron una reducción comparable de los síntomas. También tuvieron una reducción significativa en el uso de medicación de rescate (ibuprofeno 200 mg) en los últimos días del ciclo en comparación con las usuarias de EE/LNG (p<0.05), según se ha mostrado en el análisis de los objetivos secundarios del estudio. 25
Otro de los síntomas que aquejan con frecuencia es la migraña relacionada con la menstruación (MRMs, según siglas en inglés).
El uso de VE₂/DNG durante 6 ciclos mostró una reducción de las migrañas, su duración e intensidad, y la ingesta de analgésicos en el HFI. También se observó una relación directamente proporcional entre la severidad de la cefalea y los días de dismenorrea y su intensidad.
Los niveles estables de E₂ en plasma, evitan la disminución abrupta de E₂, mecanismo señalado como factor desencadenante de la MRM. Sin embargo, este no parece ser el único mecanismo. La sobreproducción de las prostaglandinas (PG) durante la menstruación podría explicar la fisiopatología de la cefalea y la dismenorrea.
El DNG es un agonista específico del receptor de progesterona con potente actividad antiinflamatoria y antiproliferativa, que reduce significativamente la liberación de moléculas implicadas en los dolores relacionados con la menstruación. 26
Otro estudio prospectivo, multicéntrico, randomizado comparó los efectos de un anticonceptivo monofásico conteniendo 1.5 mg E₂/2.5 mg NOMAC (24/4) con un monofásico conteniendo 30 µg EE/3 mg DRSP (21/7) sobre los síntomas premenstruales y menstruales usando el Moos Menstrual Distress Questionnaire Form C (MDQ-C) que incluye 47 ítems para medir cíclicamente los síntomas premenstruales, menstruales e intermenstruales.
Los resultados observados favorecieron a NOMAC/E2 en fase premenstrual y menstrual, salvo en los síntomas afectivos, excitación, sensación de bienestar, y aumento de energía o de actividad.
Las diferencias halladas en los síntomas premenstruales y menstruales con ambos regímenes pueden estar asociados a varios factores. El primer factor es la fluctuación en los niveles hormonales en el premenstruo que puede dar una variedad de respuestas anormales físicas, endocrinológicas, neurológicas y psicológicas. La disminución inicial en el EE es vista en el inicio del HFI, llevando a la discontinuación. En cambio, cuando se administra NOMAC/E₂, es el mismo estrógeno que el endógeno, siendo compensado por el ascenso del E₂ endógeno. Además, la vida media del NOMAC es 50% más larga que la DRSP (46 hs vs 30 hs), dando niveles más constantes de progestágeno. Niveles hormonales más estables dan como resultado menor variación de FSH, del diámetro folicular y de grosor endometrial.
Probablemente los progestágenos tengan diferentes efectos sobre los neurotransmisores serotoninérgicos y gabaérgicos involucrados en la sintomatología neurológica y psicológica premenstrual. 27
• Efectos en la función sexual
El uso de ACO se ha asociado en algunas mujeres con efectos indeseables en la función sexual, especialmente en el deseo y la excitación (Deseo sexual hipoactivo -DSH- asociado al uso de ACO)
Se cree que los andrógenos juegan un importante papel en la función sexual, pero se desconoce el nivel crítico de andrógenos por debajo del cual puede verse afectada la función sexual.
Los ACO pueden disminuir los niveles de testosterona libre y total por su efecto antiandrogénico y por el aumento en los niveles de SHBG.
Los ACO con gestágenos que presentan mayor androgenicidad podrían ser una mejor opción para mujeres que experimentan una menor satisfacción sexual asociada al uso de ACO, y no existe evidencia que los gestágenos más androgénicos tengan menor probabilidad de producir disfunción sexual femenina.
La hipótesis que el VE₂/DNG puede ser efectivo en el tratamiento del DSH asociado al uso de ACO se basó en el menor aumento de los niveles de SHBG vs. ACO con EE/LNG, menor disminución del nivel de testosterona y del S-DHEA.
El dienogest es un gestágeno con propiedades antiandrogénicas. 28-29
La combinación de EE/LNG se usa habitualmente para tratar el DSH asociado al uso de ACO.
El estudio STABLE tuvo como objetivo demostrar la “no-inferioridad” de VE₂/DNG vs. EE (0.03 mg)/LNG (0.15 mg) sobre la libido en mujeres con DSH asociado al uso de ACO (6 ciclos de tratamiento).
Fue el primer ensayo clínico que comparó dos ACO΄s diferentes sobre el DSH asociado al uso de ACO con cuestionarios validados para investigar la función sexual (Female Sexual Function Index - FSFI)
Los resultados de este estudio señalan que los andrógenos no parecen tener un rol relevante del DSH relacionado con el uso de ACO, sino que esta situación es compleja de causa multifactorial. Se deben considerar otros efectos aparte de la androgenicidad del gestágeno.
Estos efectos pueden estar relacionados con la magnitud del aumento en la SHBG y su impacto sobre la testosterona libre, las acciones indirectas de los ACO, como el bienestar y la imagen corporal, y los efectos sobre la vagina. No se espera que el DNG reduzca los niveles de SHBG, debido a su menor androgenicidad y la menor afinidad a la SHBG y CBG.
Desventajas
Hasta el momento hemos desarrollado las ventajas de estos estrógenos naturales y sus esquemas. Pero nos queda el interrogante de las desventajas: ¿riesgo oncológico?, ¿riesgo cardiovascular?, ¿tromboembolismo venoso?
Las investigaciones deben continuar…
Conclusiones
- A pesar de los progresos de la anticoncepción, nos queda el gran desafío como es la reducción del embarazo no planificado.
- Personalizar la elección del método para mejorar la compliance y disminuir los temores alrededor de la anticoncepción hormonal
- Disminuir los riesgos – Mejorar los beneficios
Las nuevas formulaciones nos dan a los especialistas un abanico más amplio de opciones para poder ofrecerle a cada mujer... y que ella elija la alternativa que más le convenga.
Bibliografía
-
De Leo V., Musacchio M.C., Cappelli V., Piomboni P., Morgante G. Hormonal contraceptives: pharmacology tailored to women’s health. Human Reproduction Update, Vol.22, No.5 pp. 634–646, 2016
-
ESHRE Capri Workshop Group. Hum Reprod. 2006; 12:483-497
-
Speroff L. Oral contraception. In: Clinical Gynecologic Endocrinology and Infertility; Philadelphia: Lippincott Williams & Wilkins, 2005: 861-942.
-
Gallo MF, et al. Cochrane Database of Systematic Reviews 2008, Issue 4. Art. No.: CD003989.
-
Van Vliet HA, Grimes DA, Helmerhorst FM, Schulz KF. Biphasic versus triphasic oral contraceptives for contraception. Cochrane Database Syst Rev 2006;3:CD003283
-
Guilbert E, Boroditsky R, Black A, et al. Canadian Consensus Guideline on Continuous and Extended Hormonal Contraception, 2007. J Obstet Gynaecol Can 2007;29: S1–32.
-
7. Wiegratz I, Hommel HH, Zimmermann T, Kuhl H. Attitude of German women and gynecologists towards long-cycle treatment with oral contraceptives. Contraception 2004;69:37–42.
-
Edelman A, Micks E, Gallo MF, Jensen JT, Grimes DA. Continuous or extended cycle vs. cyclic use of combined hormonal contraceptives for contraception. Cochrane Database Syst Rev 2014;29:CD004695.
-
Anderson FD, Hait H. A multicenter, randomized study of an extended cycle oral contraceptive. Contraception 2003;68:89–96.
-
World Health Organization Task Force on Oral Contraception. A randomized, double-blind study of two combined oral contraceptives continuing the same progestogen, but different estrogens. Contraception 1980;21:445–59.
-
Csemiczky G, Dieben T, Coeling Bennink HJ, Landgren BM. The pharmacodynamic effects of an oral contraceptive containing 3 mg micronized 17 beta-estradiol and 0.150 mg desogestrel for 21 days, followed by 0.030 mg desogestrel only for 7 days. Contraception 1996;54:333–8.
-
Moreau C, Cleland K, Trussell J. Contraceptive discontinuation attributed to method dissatisfaction in the United States. Contraception 2007;76:267-272.
-
13. Cheung E, Free C. Factors influencing young women΄s decision making regarding hormonal contraceptives: a qualitative study. Contraception 2005;71: 426-431.
-
Lete I, de la Viuda E, Pérez-Campos E, Martínez MÁ, Sanchez-de la Rosa R, Novalbos J, Sánchez-Borrego R. Effect on quality of life of switching to combined oral contraception based on natural estrogen: an observational, multicenter, prospective phase IV study (ZOCAL study). Eur J Contracept Reprod Health Care. 2016 Aug;21(4):276-84. doi: 10.3109/13625187.2016.1174206. Epub 2016 May 25.
-
Mueck AO, Sitruk-Ware R. Nomegestrol acetate, a novel progestogen for oral contraception. Steroids 2011 may;76(6):531-9
-
Stanczyk FZ, Archer DF, Bhavnani BR. Ethinyl estradiol and 17β-estradiol in combined oral contraceptives: pharmacokinetics, pharmacodynamics and risk assessment. Contraception. 2013 Jun;87(6):706-27.
-
Ruan X, Seeger H, Mueck AO. The pharmacology of nomegestrol acetate. Maturitas 2012 april;71(4):345-53
-
Mansour D, Verhoeven C, Sommer W y cols. Efficacy and tolerability of a monophasic combined oral contraceptive containing nomegestrol acetate and 17β-oestradiol in a 24/4 regimen, in comparison to an oral contraceptive containing ethinylestradiol and drospirenone in a 21/7 regimen Eur J Contraception Reprod Health Care. 2011; 16: 430-443.
-
Nelson A, Parke S, Makalova D, Serrani M, Palacios S, Mellinger U. Efficacy and bleeding profile of a combined oral contraceptive containing oestradiol valerate/dienogest: a pooled analysis of three studies conducted in North America and Europe. Eur J Contraception Reprod Health Care. 2013; 18 (4):430-443.
-
Jensen JT, Parke S, Mellinger U, Machlitt A, Fraser IS. Effective treatment of heavy menstrual bleeding with estradiol valerate and dienogest: a randomized controlled trial. Obstet Gynecol. 2011; 117(4): 777–87.
-
Fraser IS, Römer T, Parke S, Zeun S, Mellinger U, Machlitt A, Jensen JT. Effective treatment of heavy and/or prolonged menstrual bleeding with an oral contraceptive containing estradiol valerate and dienogest: a randomized, double-blind Phase III trial. Hum Reprod. 2011; 26(10): 2698–708.
-
Fraser IS, Parke S, Mellinger U, Machlitt M, Serrani M, Jensen J. Effective treatment of heavy and/or prolonged menstrual bleeding without organic cause: pooled analysis of two multinational, randomised, double-blind, placebo-controlled trials of estradiol valerate and dienogest. Eur J Contracept Reprod Health Care. 2011; 16(4): 258–69.
-
Bitzer J. Hormone withdrawal-associated symptoms: overlooked and under-explored. Gynecol Endocrinol. 2013;29(6):530–535
-
Sulak PJ. Continuous oral contraception: changing times. Best Pract Res Clin Obstet Gynaecol 2008;22:355–74.
-
Nappi R, et al. Noncontraceptive benefits of the estradiol valerate/dienogest combined oral contraceptive: a review of the literature. International Journal of Women’s Health 2014:6 711–718
-
Nappi RE, Terreno E, Sances G, et al. Effect of a contraceptive pill containing estradiol valerate and dienogest (E2V/DNG) in women with menstrually-related migraine (MRM). Contraception. 2013;88(3):369–375.
-
Witjes H, Creinin M D, Sundstr ö m-Poromaa I, Martin Nguyen A, Korver T. Comparative analysis of the effects of nomegestrol acetate/17 β -estradiol and drospirenone/ ethinylestradiol on premenstrual and menstrual symptoms and dysmenorrhea. Eur J Contracep Reprod Health Care, 2015; 20: 296–307
-
Nappi RE, Davis SR, Parke S, Mellinger U, Serrani M. Effects of estradiol valerate/dienogest compared with ethinyl estradiol/levonorgestrel on libido. Endocr Rev 2011
-
Von Schoultz B. Clinical efficacy and safety of combined estradiol valerate and dienogest: a new no-bleed treatment. Climacteric 2003; 6(Suppl 2): 24–32.



